En las últimas semanas os hemos hablado mucho en nuestras redes sociales sobre un tratamiento que se está probando en pacientes con lupus eritematoso sistémico (LES) refractario (es decir, que no responde a los tratamientos convencionales). Desde que saltó la noticia el pasado 15 de septiembre, hemos leído muchas barbaridades que distan bastante de la realidad. Como estamos seguros de que vamos a escuchar hablar sobre las células CAR-T mucho más, hemos decidido hablaros sobre este tratamiento.
Este artículo no hubiera sido posible sin la inestimable ayuda de los Dres. Gerard Espinosa y Manuel Juan, del Hoapital Clinic, que nos han hecho una descripción muy detallada del proceso de fabricación de las células CAR-T.
Tened en cuenta que en el proceso se describen tanto el proceso para el tratamiento del cáncer (leeréis «células malignas y células del cáncer). Dado ya un par de personas nos han preguntado, os diremos que el lupus no es cáncer.
Calma y cautela
Ya lo dijimos el otro día en redes sociales, pero lo queremos repetir otra vez. Antes de contaros en qué consisten las CAR-T, os queremos comentar un par de cosas que creemos importantes para que nuestras expectativas sean realistas con respecto a este tratamiento que está aún en una fase muy temprana de investigación como para lanzar las campanas al vuelo.
- Por el momento al menos, el tratamiento con CAR-T no es la cura del lupus como han publicado muchos medios. Los resultados del estudio son muy prometedores, pero hablamos de remisión, que quiere decir control de la enfermedad. Desgraciadamente, aún no podemos hablar de ningún modo de la cura del mismo.
- El estudio se ha llevado a cabo en una muestra muy pequeña (sólo 5 pacientes), por lo que es necesario realizar estudios en muestras más grandes de pacientes para confirmar la eficacia de este tratamiento.
- El estudio muestra resultados hasta los 3 meses de seguimiento, por lo tanto, es necesario conocer qué pasa con mayor tiempo de seguimiento para confirmar que los efectos se mantienen más allá de estos 3 meses.
- Un punto muy importante es identificar en qué perfil de pacientes será más eficaz este tratamiento, es decir, qué pacientes se van a beneficiar de su administración. Esto significa que no es un tratamiento que se deba dar en TODOS los pacientes, sino a un grupo que cumpla unos criterios muy específicos.
- Por último, el coste de este tratamiento puede superar los 300.000€ para productos aprobados en otras indicaciones, aunque justo en España tenemos un producto autorizado para su uso en también otra indicación con un coste por debajo de los 90.000€ (aunque sigue siendo un coste muy elevado).
¿Hay que tener esperanza y estar exultantes? ¡Por supuesto! Pero con mesura y siendo conscientes de que el estudio tiene sus limitaciones y aún habrá que esperar para ver resultados definitivos.
Somos conscientes de la esperanza que supone recibir noticias como ésta que ha inundado los medios estos días. Y hay motivos para tener esperanza, pero en su justa medida. Ni es la cura ni, por el momento, es un tratamiento del que se puedan beneficiar todos los pacientes.
Hechas todas estas aclaraciones, veamos en qué consiste este tratamiento.
El sistema inmune en el lupus
Como todos sabemos, el lupus es «una enfermedad autoinmune sistémica, de carácter crónico, en la que nuestras propias defensas nos atacan». Bien, vamos a complicar un poco más esta definición y os vamos a explicar uno de los motivos por los que nuestro sistema inmune nos ataca.
El sistema inmune está constituido por una serie de células, cada una con una función específica que tiene por objeto protegernos frente a agentes patógenos (malos o extraños). De este modo, cuando hay un intruso (agente patógeno), se activan una serie de procesos por los que se produce una respuesta inmunitaria.
Uno de los tipos celulares de defensa encargados de activar el sistema inmune son los linfocitos y en concreto, los linfocitos B que, junto con los linfocitos T, juegan un papel importante en el desarrollo del LES.
De una forma muy resumida y sencilla, cuando un virus (agente patógeno, extraño o malo) entra en contacto con nuestro organismo, unas células (las llamadas células presentadoras de antígeno) se encargan de «coger» una parte de este virus llamada antígeno y presentarlo a los linfocitos T. Éstos reconocen el antígeno como un agente invasor contra el que hay que luchar, se activan y se “lo comunican” a los linfocitos B, que van a dar lugar a los anticuerpos que son los encargados de eliminar a estos antígenos.
Existe un sistema de control por el que los linfocitos T sólo se activan frente a estos antígenos extraños o malos de virus, bacterias y otros agentes patógenos. En el LES este sistema control falla y el sistema inmunitario no es capaz de reconocer que algunos antígenos son propios del mismo, es decir, los linfocitos T no son capaces de distinguir un agente extraño de uno propio y además existe una alteración en la regulación de los linfocitos B, que se activan en exceso, produciendo una cantidad excesiva de autoanticuerpos.
Las células B y su papel en el lupus y otras enfermedades autoinmunes
Como hemos visto, las células B tienen un papel fundamental en el desarrollo de enfermedades autoinmunes como el lupus. No sólo producen anticuerpos, sino que regulan la acción de otras células inmunitarias, segregan citocinas y presentan antígenos que, a su vez, activan a los linfocitos T.
Debido a la hiperactividad de las células B en el lupus, los investigadores encaminan parte de sus esfuerzos a desarrollar tratamientos cuyo objetivo sea disminuir el número de linfocitos B o esta hiperactividad. Un ejemplo de ello es el rituximab, que es el tratamiento de depleción (eliminación) de células B más usado en el lupus, a pesar de no tener la aprobación específica.
Otro tratamiento que actúa sobre las células B es el belimumab. Éste cuenta con la indicación en pacientes con LES activo moderado que no responde al tratamiento convencional y, de forma reciente, ha obtenido la aprobación para el tratamiento de la nefritis lúpica (afectación del riñón) añadido al tratamiento estándar. Rituximab y belimumab actuarían frente a los linfocitos B aunque por vías diferentes.
Por tanto, si fuésemos capaces de provocar la eliminación del subtipo de linfocitos B causante de la producción de los autoanticuerpos podríamos controlar mejor la enfermedad. ¿Cómo podríamos destruir estas células B de manera más efectiva? Esto se consigue a través de modificar genéticamente los linfocitos T para “darles” la orden de «matar» a las células B. En esto consiste el tratamiento con células CAR-T.
¿Qué es el tratamiento con células CAR-T?
El nombre procede del acrónimo en inglés Chimeric Antigen Receptor T-Cell o terapia de células T con receptores quiméricos frente a antígenos. Consiste en la extracción de células T del paciente, la modificación genética de las mismas (lo que luego llamamos “re-programación” de los linfocitos T) y la infusión de estos mismos linfocitos T modificados de nuevo al paciente. De este modo, el paciente se convierte en su propio donante. La primera y principal aplicación de este tratamiento está siendo el campo del cáncer.
Este tratamiento se aprovecha de que las células del cáncer presentan en su superficie antígenos o “marcadores” específicos. Mediante una modificación genética, los linfocitos T se programan para que reconozcan estos “marcadores” como extraños y, por tanto, iniciar una respuesta inmune frente a las células que los tengan (en este caso, las células del cáncer) y eliminarlas. Este tratamiento representa un nuevo paradigma ya que se usa el propio sistema inmune del paciente para que, en este caso, destruya las células cancerígenas.
En el caso del lupus, los linfocitos B productores de los autoanticuerpos que intervienen en la aparición y desarrollo de la enfermedad tienen en su superficie varios marcadores como CD19 o CD20. De hecho, el rituximab va dirigido frente a CD20. Lo que se ha hecho en este estudio es re-programar a los linfocitos T del mismo paciente para que vayan contra los linfocitos B que tengan en su superficie el CD19. Con esto se consigue una eliminación (depleción) mucho más efectiva de estos linfocitos B, y potencialmente un mejor control (que no curación) de la enfermedad.
¿Cómo se logra que los linfocitos T vayan contra las células malignas en los pacientes con cáncer o contra los linfocitos B CD19 en el caso de los pacientes con LES? Introduciéndoles un gen (modificación genética) que hace que el linfocito T reconozca el marcador específico de las células malignas o el CD19 de los linfocitos normales en el caso del LES.
¿Y cómo se administra este tratamiento?
El proceso de elaboración de las células CAR-T es algo complejo, por lo que nos vamos a servir de la siguiente figura para explicarlo:
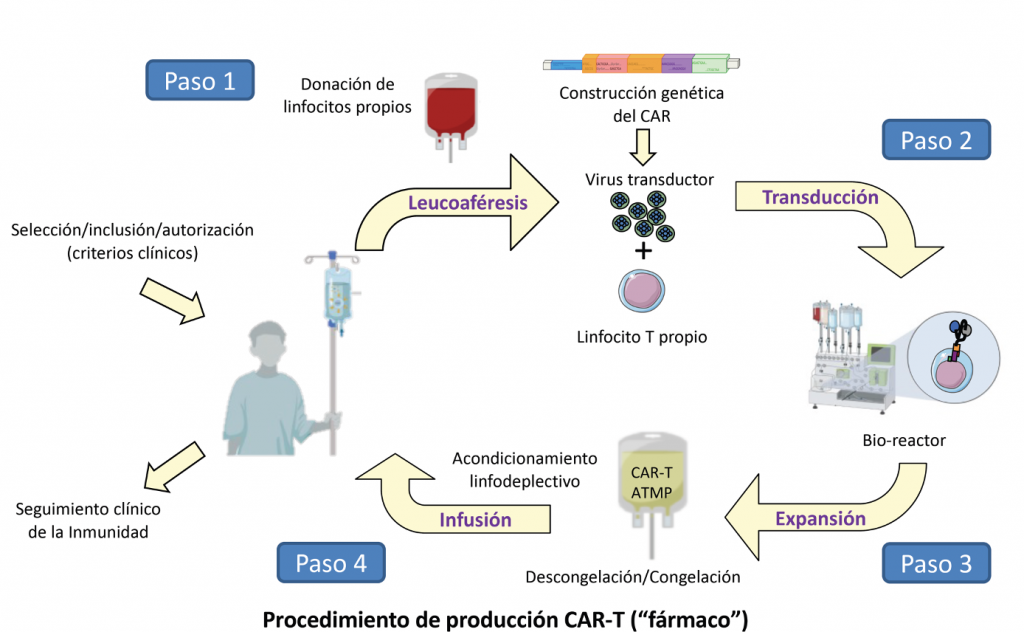
En primer lugar, es necesario extraer los linfocitos T del paciente. Para ello se le somete a un proceso llamado leucoaféresis, por el que toda la sangre pasa a través de una máquina que identifica y extrae los linfocitos y devuelve el resto de la sangre al paciente (paso 1).
Las células T extraídas en la leucoaféresis son luego purificadas, activadas y modificadas genéticamente fuera del paciente (en equipos más o menos automatizados, llamados bio-reactores, que se manipulan con grandes medidas de seguridad y con la máxima garantía de calidad en un laboratorio específico para células llamado “sala blanca”)(paso2). En el caso del lupus, lo que se hace es insertar un gen que hace expresar un receptor de antígeno quimérico contra la proteína CD19 de las células B. Esto, que suena tan complicado, es lo que hará que los linfocitos T cambien, se redirijan a actuar y comiencen a destruir los linfocitos B que tengan en su superficie el CD19.
El siguiente paso, el paso 3, es lograr que las células T extraídas y modificadas genéticamente se multipliquen en el laboratorio.
Por último, una vez evaluadas con los máximos requerimientos de calidad, pues se convierten en un fármaco a todos los efectos, se procede a la infusión de estas células CAR-T al paciente, que es sometido previamente a un proceso de reducción de los linfocitos normales (linfodeplección), para “dar espacio a los CAR-T” cuando se infuden; esta linfodeplección se realiza con fármacos que también se usan en diversas quimioterapias con diversos objetivos terapéuticos, tanto en cáncer como en otras enfermedades. De este modo, las células T que los pacientes tienen en la sangre se reducen antes de recibir las que se han modificado genéticamente (paso 4).
¿Qué estudios se han llevado a cabo hasta ahora con células CAR-T en lupus?
La terapia con células CAR-T comenzó a estudiarse en los ratones con lupus (modelo animal). En dichos estudios se observó que tras la administración de las células CAR-T, se producía la eliminación de los linfocitos B, que la producción de autoanticuerpos cesaba y que las manifestaciones clínicas que presentaban los ratones se solucionaban.
Tras estos resultados, Mougiakakos y colaboradores probaron este tratamiento en una paciente de 20 años de edad con LES grave, con afectación de los riñones (nefritis lúpica), del corazón en forma de pericarditis, afectación de las articulaciones (artritis) y de la piel, entre otras. La paciente no había respondido a ningún tratamiento de los que había recibido.
Tras la administración de la terapia con células CAR-T, los anticuerpos anti-dsDNA se negativizaron y los niveles de complemento se normalizaron. La paciente consiguió la remisión clínica (quedarse sin manifestaciones clínicas) y el índice de actividad medido con un índice llamado SLEDAI bajó de 16 a 0. En este punto es importante recordar que los anti-dsDNA y el complemento son los marcadores que indican la actividad inmunológica del lupus y que la definición de remisión del grupo DORIS, de la que ya os hemos hablado, requiere, entre otras cosas, de un índice SLEDAI igual a cero.
Tras los resultados de estos estudios, Georg Schett y su equipo decidieron llevar a cabo un estudio en una muestra pequeña de pacientes con LES grave en los que otros tratamientos no habían tenido éxito (LES refractario). Y es sobre este estudio del que os hablamos en el siguiente artículo que os recomendamos que leáis.
Sin duda y, como hemos dicho al principio, no será la última vez que oigamos hablar sobre las células CAR-T, pero esperamos que toda la información que os hemos proporcionado os ayude no sólo a comprender en qué consiste el tratamiento, sino también a tener unas expectativas reales del mismo.
Artículos relacionados:
- La terapia con células CAR-T Anti-CD19 en el tratamiento del lupus eritematoso sistémico refractario.
- Genética y lupus.
- El gen TLR7 y su implicación en el lupus.
- Belimumab.
Fuentes:
- Kansal, R. et al. Sustained B cell depletion by CD19-targeted CAR T cells is a highly effective treatment for murine lupus. Sci. Transl. Med. 11, eaav1648 (2019).
- Jin, X. et al. Therapeutic efficacy of anti-CD19 CAR T cells in a mouse model of systemic lupus erythematosus. Cell Mol. Immunol. 18, 1896–1903 (2021).
- Parodis, I et al. B cells in systemic lupus erythematosus: Targets of new therapies and surveillance tools. Front. Med. 2022 https://doi.org/10.3389/fmed.2022.952304
- Mougiakakos, D. et al. CD19-targeted CAR T cells in refractory systemic lupus erythematosus. N. Engl. J. Med. 385, 567–569 (2021).
Licenciada en Economía y autora del blog Tu Lupus Es Mi Lupus.
EUPATI fellow.
Community manager en Lupus Europe, AMELyA Lupus Madrid, ACOLU Lupus Córdoba y SAF España.
Redactora web en AMELyA Lupus Madrid y en SAF España.

El Dr. Manel Juan es jefe del servicio de inmunología en el Centro de Diagnóstico Biomédico (CDB) del Hospital Clínic, del grupo Inmunogenética en la respuesta autoinflamatoria del IDIBAPS y responsable de las plataformas conjuntas del Hospital Sant Joan de Déu y Banc de Sang i Teixits.
-
Este autor no ha escrito más artículos.




