La respuesta es que no. Sin embargo, como siempre, mejor dejamos que los especialistas nos expliquen el porqué.
Lo que los pacientes sí que debemos tener claro es que los biosimilares pueden ser tan seguros y eficaces en el tratamiento como lo son los biológicos. Recordad que cada paciente es diferente y que, por tanto, su reacción ante una determinada medicación también lo será.
Si aún no sabes qué son los tratamientos biológicos y los biosimilares, te recomendamos que leas sendos artículos publicados en esta misma web. ¡Te sacarán de dudas! también, como siempre, te recomendamos que hables con tu médico en relación a éste y otros temas relacionados con el cuidado y seguimiento de tu salud.
Este artículo es cortesía del Dr. Pallarés, en colaboración con nuestros compañeros de la Asociación de Lupus de Islas Baleares (AIBLUPUS). ¡Gracias!
Biológicos y biosimilares: ¿son lo mismo?
Recientemente, se han desarrollado ponencias y debates acerca de los tratamientos biológicos y los biosimilares, y sobre si son, o no son, “lo mismo”. La respuesta es que no son lo mismo, aunque ello no signifique que no puedan lograr el mismo efecto y resultados en el paciente.

Coste y control
El fármaco “biológico” tiene una patente y un coste elevado, que se explica por todo el proceso de fases de pruebas (ensayos) que ha tenido que pasar para conocer no sólo su efecto beneficioso, sino su seguridad, así como toda una serie de controles que garantizan su calidad.
El fármaco “biosimiliar” es una copia del “biológico”, que sólo tiene que demostrar que es igual de efectivo, pues al ser una copia se le supone la misma seguridad y calidad, y por tanto no tiene la necesidad de pasar todas las fases y controles que ha tenido que pasar el “biológico”. Esto evita gastos, lo que hace posible que los tratamientos biológicos se puedan obtener a un coste menor.
Esta “copia” del fármaco “biológico” y su salida al mercado como fármaco “biosimilar” sólo puede hacerse cuando vence la patente de la molécula del “biológico”, que suele suceder a los 10 años aproximadamente.
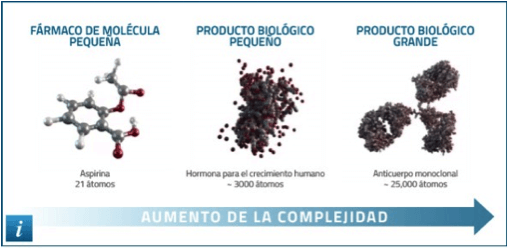
El vencer la patente significa que puedo copiar la molécula, pero “no es la misma molécula” sino una copia. Si fuera la misma molécula no se llamaría “biosimilar”, sino “bioidéntico”. Y no es lo mismo ser “similar” a algo, que ser “idéntico” a algo. Para que la molécula sea la misma, el laboratorio debe querer “vender” la molécula, pero mientras tenga su propiedad aunque haya vencido la patente, yo puedo copiarla, pero no es la misma exactamente igual. Esto es así porque son moléculas complejas, estructuras complejas tridimensionales, que pueden coincidir en un 90% pero no en el 100%. Os adjunto una foto de la estructura de la conocida aspirina, y la de un anticuerpo monoclonal, que es lo que son la mayoría de tratamientos “biológicos” para las enfermedades autoinmunes. Podéis ver la gran complejidad de la estructura del anticuerpo.
Los biosimilares son evaluados en relación a su calidad y seguridad
El problema surge porque, aunque el efecto o resultado sobre la enfermedad pueda ser el mismo, no siempre se puede asegurar que el “biosimilar” tenga la misma seguridad clínica y la misma calidad que el original “biológico”. En el mundo de los fármacos “biosimilares”, tenemos diferentes grados de calidad y de seguridad.
Las Agencias del Medicamento son las encargadas de evaluar el fármaco “biosimilar” y garantizar que poseen el mismo grado de efectividad terapéutica así como su seguridad y su calidad. Sólo así se puede proceder al uso de los fármacos “biosimiliares”, pues no hay que olvidar que su ahorro y bajo precio es a costa de acortar las fases de evaluación y poder así sacarlo antes al mercado.
Fte: www.hospira.es
Ahora que hemos visto la complejidad de estas estructuras, entendemos que podemos elaborar una “copia” que consiga el mismo efecto, y de la que suponemos igual calidad y seguridad clínica. Pero alguien nos tendrá que confirmar que eso es así, y ese alguien es el Ministerio a través de la Agencia del Medicamento.
Sustitución de tratamientos biológicos por biosimilares
Finalmente, dada la complejidad molecular de estos fármacos, aún en el caso de comprobar que un fármaco “biosimilar” tiene las mismas garantías de resultados, seguridad y calidad que el “biológico” original, su indicación y sustitución de unos por otros, debe realizarse, a fecha de publicación de este artículo, de forma individual por los profesionales responsables de los pacientes, y nunca de forma automática como se hace en el caso de los denominados fármacos “genéricos”, pues no pueden compararse unos con otros.
En este sentido, el uso de fármacos “biosimilares” estaría indicado al inicio de un tratamiento de acuerdo con la información y decisión del médico y del paciente, pero no para sustituir de forma automática un tratamiento “biológico” que ya se está utilizando en una persona, por uno “biosimilar”.
Espero haber podido aclarar algunos conceptos en este tema. Os aconsejo leer estos dos artículos, que son un reflejo del debate.
- Redacción Médica (Junio 2013): «Biológicos y Biosimilares: no es lo mismo«, escrito por Ramón Sánchez Díaz Calderón
- Reumatología Clínica, Vol 10, Num 6, Nov-Dic 2014: «Mitos y realidades sobre los medicamentos biosimilares«, por César Hernández-García.
Artículos relacionados:
Artículo redactado por el Dr. Pallarés Ferreres.
Artículo actualizado en septiembre de 2022.

El Dr. Pallarés es médico especialista en medicia interna, con especial interés en enfermedades autoinmunes. Actualmente es coordinador de la unidad de enfermedades autoinmunes sistémicas del Hospital Universitario Son Espases de Mallorca
- Este autor no ha escrito más artículos.