Tal y como os comentamos en un artículo publicado en marzo de 2022, el anifrolumab es un tratamiento biológico que fue aprobado para el lupus tras el éxito de la fase III de ensayo clínico, que se llevó a cabo a través de los estudios TULIP-1 y TULIP-2.
El pasado mes de noviembre se publicó un estudio que corrobora la seguridad y eficacia de este tratamiento en el lupus eritematoso sistémico.
¿Qué es el anifrolumab?
El anifrolumab es un anticuerpo monoclonal humano cuya función es la de bloquear la vía de señalización del interferón IL-1. Puedes leer más información sobre este tratamiento en el artículo que tienes al final de este texto, en el apartado «Artículos relacionados».
¿Por qué se ha llevado a cabo este estudio, si el tratamiento ya estaba aprobado?
La investigación no cesa tras la aprobación de un tratamiento, sino que continúa de manera indefinida a través de diversos tipos de estudios entre los que se incluyen los estudios de cohortes, registros de pacientes y estudios observacionales.
También es normal que se hagan extensiones de estudios o estudios en fase IV para comprobar la seguridad y eficacia a largo plazo de un tratamiento concreto.
¿En qué consistió el estudio a largo plazo del anifrolumab?
Para comprobar la seguridad y tolerabilidad del anifrolumab, se ofreció a los pacientes que habían participado en la fase III del ensayo clínico (TULIP-1 y TULIP-2) participar en esta extensión del estudio.
El objetivo de este estudio era, en concreto, evaluar la seguridad y tolerabilidad de 300 mg de anifrolumab a largo plazo en un ensayo clínico de fase 3, aleatorizado, doble ciego, controlado por placebo. Esto significa que se dividió a los pacientes en 2 grupos de manera aleatoria: a uno se le administró anifrolumab y a otro, placebo. Ni los pacientes ni los investigadores sabían qué grupo recibía uno y otro.
En este estudio concreto se llevó a cabo la división de pacientes de tal forma que los que recibieron anifrolumab en los estudios TULIP-1 y TULIP-2 siguieron haciéndolo. Sin embargo, los que recibieron placebo fueron divididos de forma aleatoria de tal modo que unos pasaron a recibir anifrolumab, mientras que otros continuaron con placebo.

El estudio tuvo una duración de 3 años durante los cuales se administró a los pacientes una dosis de 300 mg de anifrolumab o placebo cada 4 semanas, lo que hizo un total de 39 dosis.
Y, como siempre nos lo preguntáis, os diremos que este estudio se realizó a nivel mundial: EE.UU., Colombia, México, Perú, Chile, Argentina, Reino Unido y España (Madrid, Barcelona, Mérida, Sevilla y Vigo), entre muchos otros.
¿Cuáles fueron los resultados del estudio?
A pesar de las limitaciones de este estudio, los autores concluyen que el anifrolumab tiene un perfil de seguridad aceptable en el largo plazo y que, además, permite mejoras en la actividad de la enfermedad, así como la reducción de las dosis de corticoides. Por tanto, el anifrolumab se trata de una buena opción como tratamiento del LES moderado-grave en el largo plazo.
Los eventos adversos observados fueron similares en los pacientes que recibieron anifrolumab 300 mg y los que recibieron placebo. Los más comunes fueron nasofaringitis, infección de vías urinarias e infecciones respiratorias superiores.
La incidencia de efectos adversos serios en el primer año de este estudio en el grupo de anifrolumab fueron similares a los observados en los estudios TULIP y que podéis encontrar en el artículo que escribimos sobre el anifrolumab. Estos porcentajes disminuyeron con el tiempo en este estudio de extensión.
El porcentaje de infecciones oportunistas fue similar en el grupo anifrolumab y en el placebo.
En relación con la infección por herpes zóster, en los estudios previos con anifrolumab se había observado un alto número de pacientes con este efecto adverso. Sin embargo, en este estudio a largo plazo se observó una disminución en la incidencia a lo largo de tiempo. Esto sugiere que el riesgo de herpes zóster con anifrolumab es mayor en el primer año de tratamiento.
Aprovechamos la mención al herpes zóster para recordarte que las recomendaciones EULAR de vacunación en pacientes con enfermedades reumáticas y musculoesqueléticas incluyen la vacuna contra el herpes zóster en pacientes de riesgo y que han sido ya varias las ponencias a las que hemos asistido y en las que especialistas recomiendan esta vacuna a los pacientes con lupus.
Aunque no figurara en los objetivos iniciales del estudio, los investigadores también evaluaron la efectividad del anifrolumab y observaron lo siguiente:
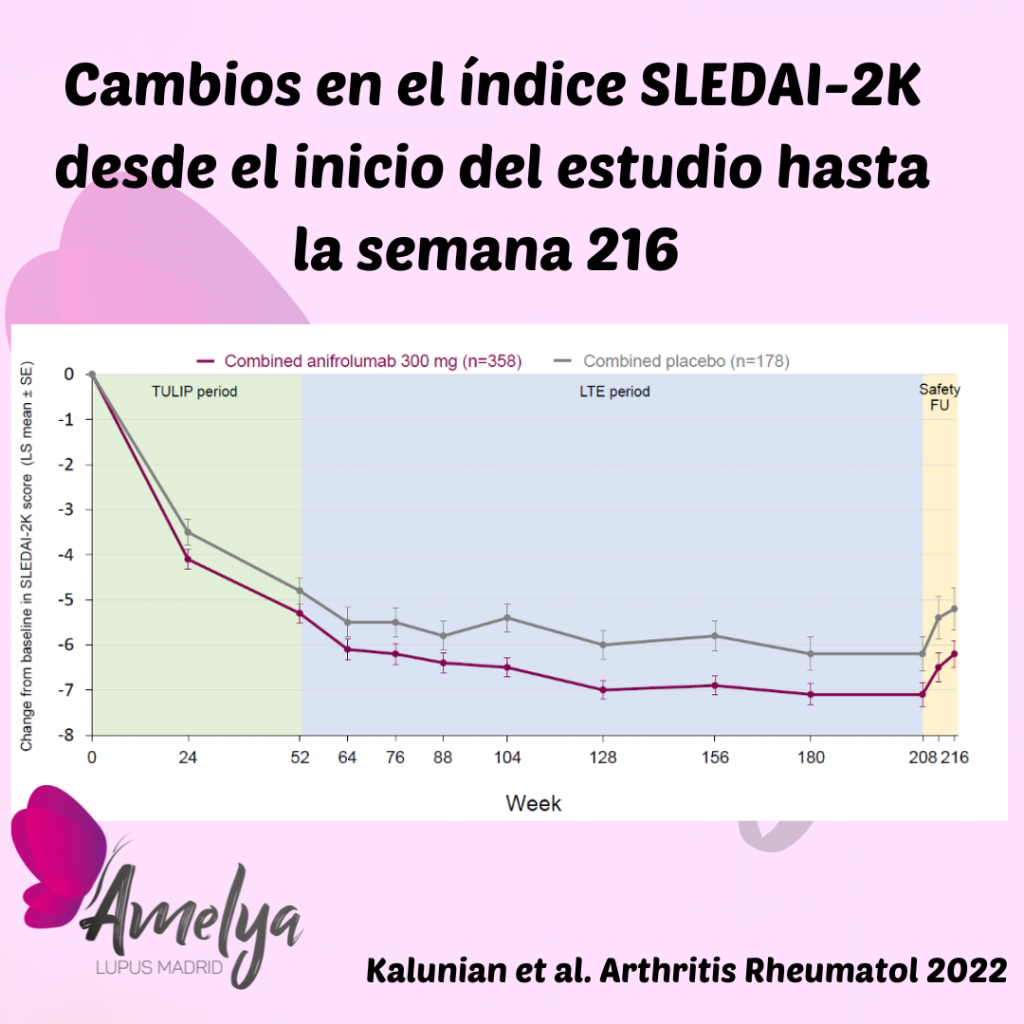
El índice de actividad SLEDAI-2K, en el cual se observó una mejora sustancial en los estudios TULIP, siguió mejorando durante esta extensión del estudio en comparación con el grupo placebo. Además, la mejora fue sostenida en el tiempo y la media en los niveles de actividad del lupus se mantuvo baja a lo largo del estudio. Recordemos que cuanto menor es este índice, menor será la actividad de la enfermedad.
Por último, el tratamiento con 300 mg de anifrolumab permitió la reducción en las dosis de corticoides y un uso de dosis acumulativas de corticoides más bajo en comparación con el grupo placebo.
En el año 4 de estudio, el 36,4% de los pacientes con anifrolumab habían podido dejar los corticoides y el 74,4% estaban recibiendo dosis de 0 mg/día o menos de 5 mg/día. Esto podría haber contribuido a la menor prevalencia de efectos adversos con anifrolumab, ya que el uso de corticoides se asocia con efectos adversos como daño acumulado, osteonecrosis, eventos cardiovasculares y osteoporosis con fracturas.
Llamada a la responsabilidad en la participación en ensayos clínicos
Nos ha llamado la atención el elevado número de abandonos en este ensayo clínico. Según el estudio publicado, el 69,3% de los pacientes que estaban en el grupo anifrolumab terminaron el estudio (esto es, 178 de 257 pacientes). En el grupo placebo, tan sólo el 48,2% de los pacientes terminaron el estudio (54 de 112 pacientes).
Las razones más frecuentes de abandono fueron: abandono del propio paciente y falta de eficacia.
Como hemos dicho en múltiples ocasiones, no es posible tener nuevos tratamientos sin la participación del paciente en los ensayos clínicos. Sin embargo, la participación en un ensayo clínico requiere de un elevado grado de compromiso por parte del paciente.
Los ensayos clínicos son totalmente voluntarios y, si bien es cierto que el paciente puede abandonar el estudio en cualquier momento sin necesidad de tener que dar explicación alguna, nos gustaría apelar al sentido de la responsabilidad.
Artículos relacionados:
- El anifrolumab como tratamiento para el lupus.
- Los corticoides.
- Recomendaciones EULAR de vacunación en pacientes con enfermedades reumáticas y musculoesqueléticas
- Puedes consultar más tratamientos en la sección «Tratamientos«.
Fuentes:
- Kalunian, K.C., Furie, R., Morand, E.F., Bruce, I.N., Manzi, S., Tanaka, Y., Winthrop, K., Hupka, I., Zhang, L., Werther, S., Abreu, G., Hultquist, M., Tummala, R., Lindholm, C. and Al-Mossawi, H. (2022), A Randomized, Placebo-Controlled Phase III Extension Trial of the Long-Term Safety and Tolerability of Anifrolumab in Active Systemic Lupus Erythematosus. Arthritis Rheumatol. https://doi.org/10.1002/art.42392
Licenciada en Economía y autora del blog Tu Lupus Es Mi Lupus.
EUPATI fellow.
Community manager en Lupus Europe, AMELyA Lupus Madrid, ACOLU Lupus Córdoba y SAF España.
Redactora web en AMELyA Lupus Madrid y en SAF España.

El Dr. Rascón es licenciado en Medicina y Cirugía por la Universidad Autónoma de Madrid y especialista en Medicina Interna vía MIR en el Hospital Son Dureta.
Posee un máster en Manejo Clínico de Enfermedades Autoinmunes (Universidad de Barcelona) y otro máster en Gestión Clínica de Unidades Asistenciales (Universidad Juan Carlos I de Madrid).
Además, es miembro de la Sociedad Catalanobalear de Medicina Interna y de la Asociación de Salud Digital.



