¡Grandes noticias! La voclosporina ya está disponible para pacientes en España desde el pasado 1 de diciembre.
Este hito significativo ha sido posible gracias a un riguroso proceso de aprobación que os detallamos en este artículo.
¿Qué es la voclosporina?
Como ya os explicamos en el artículo que publicamos con la noticia de su aprobación, se trata del primer inhibidor de la calcineurina autorizado en Europa para tratar a adultos con nefritis lúpica activa de clase III, IV o V (incluyendo las clases mixtas III/V y IV/V).
Al final de este texto podéis encontrar los artículos sobre los resultados de la fase III del ensayo clínico, tras la cual se aprobó el tratamiento, así como el artículo sobre la noticia de su aprobación por la Agencia Europea del Medicamento (EMA).
Si la voclosporina ya estaba aprobada, ¿por qué no estaba disponible?
El proceso de investigación y desarrollo de medicamentos es largo y consta de varias fases.
Tras la aprobación de un tratamiento por las autoridades sanitarias europeas (EMA), cada país debe evaluar, de forma individual, cada tratamiento antes de ponerlo a disposición de los profesionales sanitarios.
Os dejamos esta imagen que muestra las fases y duración del proceso de I+D.
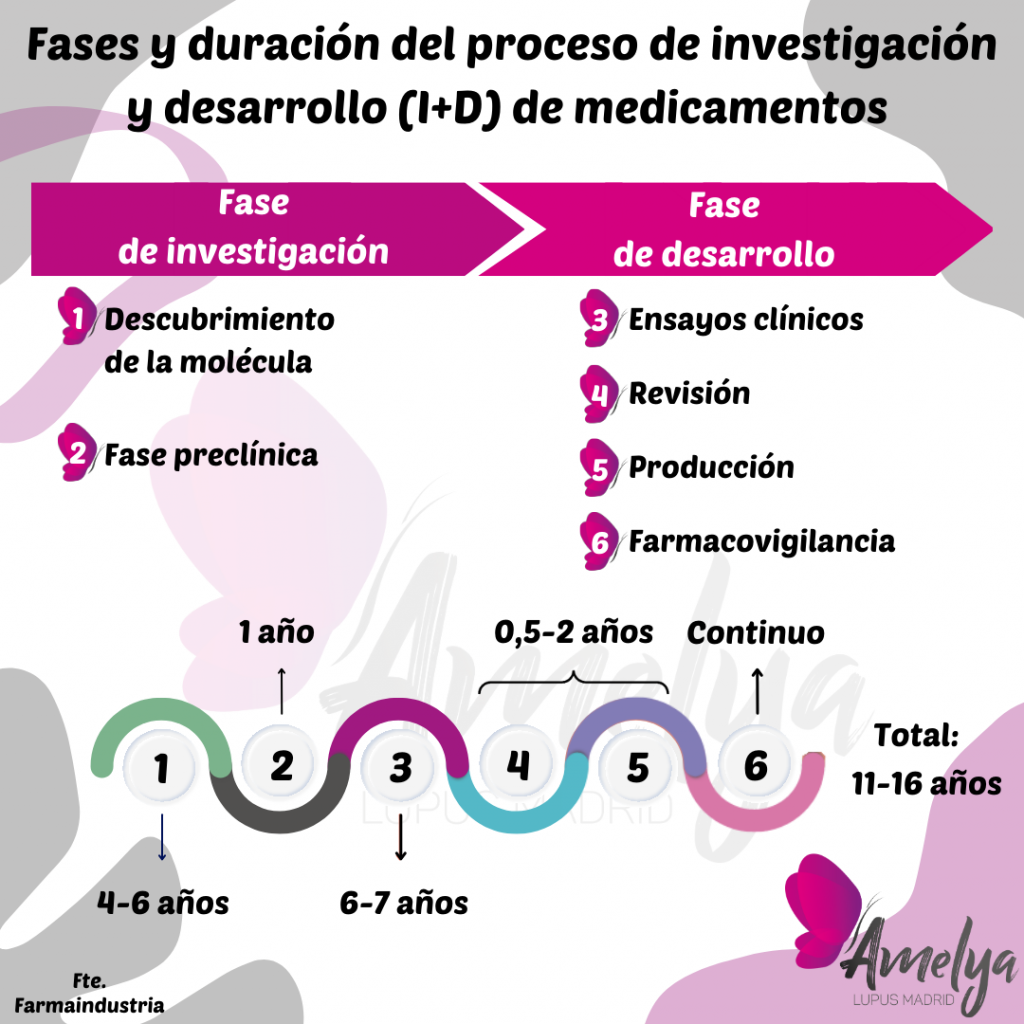
En el caso de la voclosporina, en septiembre de 2022, la Comisión Europea (CE) otorgó su autorización después de revisar los resultados positivos del ensayo clínico de fase III.
No obstante, y como hemos dicho anteriormente, la aprobación de un medicamento no garantiza su disponibilidad inmediata para todos los pacientes.
Para que un medicamento pueda ser usado en los hospitales y centros de salud del Sistema Nacional de Salud (SNS), primero debe ser autorizado para su venta y luego debe ser incluido en la lista de medicamentos financiados con fondos públicos.
Estos dos pasos son cruciales para que el medicamento esté disponible en nuestro sistema de salud público.
El primer paso es la autorización de comercialización, que es como el «permiso» que necesita un medicamento para llegar a los pacientes.
Hay diferentes formas de obtener este permiso:
- A nivel nacional, donde el laboratorio solicita la autorización en un solo país y es evaluado por la agencia reguladora de ese país.
- A nivel centralizado, donde el medicamento obtiene autorización para toda la Unión Europea después de ser evaluado por la Agencia Europea del Medicamento (EMA).
- Procedimientos descentralizado y de reconocimiento mutuo, en los que el medicamento se evalúa en varios países de la Unión Europea, pero no en todos.
En todos estos procedimientos, el laboratorio presenta documentación científica de respaldo y las autoridades regulatorias evalúan esta información en función de la eficacia, calidad y equilibrio entre beneficios y riesgos. Si todo cumple con los criterios establecidos, se emite la autorización para la comercialización.
Es importante entender que obtener la autorización no significa automáticamente que el medicamento esté disponible en el sistema de salud.
Después de obtener la autorización, el medicamento debe ser incluido en la prestación farmacéutica del SNS para que sea financiado con fondos públicos y accesible para los pacientes. Este proceso implica coordinación entre entidades reguladoras, laboratorios farmacéuticos y autoridades de salud para garantizar que los medicamentos aprobados estén disponibles y accesibles para quienes los necesitan.
La financiación pública de los medicamentos en España es competencia exclusiva del Estado, específicamente del Ministerio de Sanidad a través de la Dirección General de la Cartera Común de Servicios del Sistema Nacional de Salud y Farmacia (DGCYF,) para garantizar la equidad en el acceso a los tratamientos en todo el país.
El procedimiento de financiación y fijación de precios está establecido en la Ley de Garantías y Uso Racional de Medicamentos y Productos Sanitarios (LGURM).
Los criterios para la financiación incluyen la gravedad de las patologías, las necesidades de ciertos grupos, el valor terapéutico y social del medicamento, la relación coste-efectividad, la racionalización del gasto público, la existencia de alternativas a menor precio y el grado de innovación del medicamento.
La Comisión Interministerial de Precios de Medicamentos (CIPM), adscrita al Ministerio de Sanidad, es el órgano encargado de fijar los precios de los medicamentos en España.
Esta comisión, compuesta por representantes de diversos ministerios y autoridades autonómicas, juega un papel crucial en determinar la accesibilidad y viabilidad económica de los medicamentos en el sistema de salud público.
Si quieres más información, te dejamos en las fuentes un artículo de Farmaindustria y el documento informativo sobre la financiación y la fijación de precios de los medicamentos en España.
¡Seguiremos informando!
La llegada de voclosporina a España representa un avance significativo en la atención a pacientes con lupus, ya que permite disponer de un arsenal terapéutico más amplio que esperamos redunde en una mejor calidad de vida para los pacientes con lupus.
Artículos relacionados:
- La voclosporina supera la fase III de ensayo clínico.
- La voclosporina ha sido aprobada en Europa para el tratamiento de la nefritis lúpica en adultos.
- Más noticias de lupus, aquí.
Fuentes:
- iSanidad: Llega a España el primer inhibidor de la calcineurina aprobado para la nefritis lúpica activa.
- Ministerio de Sanidad de España: Documento informativo sobre la financiación y la fijación de precios de los medicamentos en España.
- Farmaindustria: El precio de los medicamentos.
Licenciada en Economía y autora del blog Tu Lupus Es Mi Lupus.
EUPATI fellow.
Community manager en Lupus Europe, AMELyA Lupus Madrid, ACOLU Lupus Córdoba y SAF España.
Redactora web en AMELyA Lupus Madrid y en SAF España.



